Neurologie/ Labormedizin: Das flüssige Gold des Neurologen - der Liquor cerebrospinalis
)
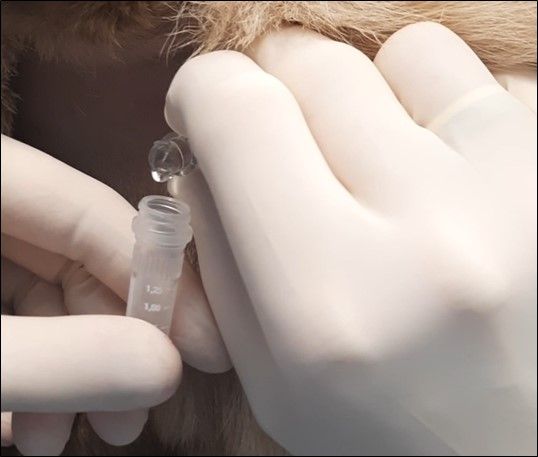
Abbildung 1: Cisternale Liquorentnahme mit einer speziellen Spinalkanüle bei einem Hund
Liquor cerebrospinalis
Der Liquor cerebrospinalis wird als Ultrafiltrat aus Blut in den Plexus choroidei gebildet, fließt dann durch die inneren Liquorräume, also dem Ventrikelsystem und dem Zentralkanal, und auch durch den äußere Liquorraum, also im Subarachnoidalraum, in dem er auch punktiert werden kann. Die Resorption erfolgt an mehreren Orten: an den Arachnoidalzotten, im Bereich der Nervenwurzeln und es fließt auch Liquor über das Perineurium der Hirn- und Spinalnerven ab. Der Liquor ist im Normzustand wasserklar, sowie protein- und zellarm.
Der Liquor cerebrospinalis hat zum einen eine wichtige Schutzfunktion durch die Polsterung des zentralen Nervensystems und die Neutralisierung die Schwerkraft. Zum anderen dient er dem Stoffwechsel der Nervenzellen, sowie dem Abtransport von Abfallstoffen aus dem ZNS und ist vermutlich auch an Signalkaskaden beteiligt.
Die Liquorentnahme
Indikationen für eine Liquorentnahme:
- Aufarbeitung eines Patienten mit einer zentralnervösen Erkrankung
- Junge Hunde mit zervikaler Dolenz (Verdacht auf SRMA)
- Fieber unklarer Genese
- Verdacht auf eine multifokale oder diffuse Erkrankung
Relative und absolute Kontraindikationen:
- Vermutete oder bekannte Atlantoaxiale Instabilität (nicht cisternal entnehmen!)
- Bestehende Kleinhirnherniation durch das Foramen magnum
- Bekannte erhebliche intrakranielle Raumforderung(en) und/oder Hinweise auf einen erhöhten intrakraniellen Druck, was bei einer Liquorpunktion zur Herniation des Kleinhirns durch das Foramen magnum führen könnte
- Gerinnungsstörungen
Die Liquorentnahme kann generell cisternal, also aus der Cisterna magna, oder lumbal erfolgen. Die Höhe der lumbalen Punktion ist von der Tierart und der Größe des Tieres abhängig. So wird bei der Katze im Allgemeinen die Punktion im Bereich zwischen L6/7 oder L7/S1 empfohlen und beim Hund zwischen L4/5 bis L7/S1. Hierbei ist zu beachten je kleiner der Hund, desto weiter hinten sollte punktiert werden, um das Rückenmark nicht zu verletzten. Bei großen Hunden endet der Durasack durch den Ascensus medullae spinalis (den scheinbaren Aufstieg des Rückenmarks durch das Längenwachstum der Wirbelkörper) jedoch deutlich weiter vorne, sodass für eine erfolgreiche Punktion in einigen Fällen auch der Bereich L4/5 genutzt werden muss.
Der Liquor sollte immer nahe der Läsion und möglichst kaudal der Läsion (damit der Liquor an der Läsion vorbeigeflossenen ist) entnommen werden. Also bei intrakraniellen Veränderungen sollte aus der Cisterna magna entnommen werden. Bei thorakolumbalem Problemen im kaudalen Lendenwirbelsäulenbereich. Problematisch sind Pathologien im Bereich der Halswirbelsäule, hier kommt es etwas auf die Höhe der Läsion an. Bei hochzervikalen Läsionen wird eher eine cisternale Punktion empfohlen, bei tiefen Läsionen eher lumbal. Tatsächlich ist es in einigen Fällen sogar ratsam an beiden Stellen eine Liquorentnahme und eine vergleichende Analyse des Liquors vorzunehmen.
Punktiert werden sollte ausschließlich mit einer SPINALKANÜLE. Diese speziellen Kanülen haben einen verkürzten Anschliff, da bei normalen Injektionskanülen der Anschliff zu lang ist und dies Schäden an der Medulla oblongata oder am Rückenmark verursachen kann. Entnommen werden kann als Richtwert eine Menge von 1 ml pro 5 kg Hund bzw. etwa 0,75 ml (-1 ml) pro Katze. Bei kleinen Hunden (z.B. 1,2 kg Chihuahua) kann dies natürlich problematisch sein, da in der Regel eine Mindestmenge von etwa 0,75 ml für eine komplette Liquoranalyse benötigt werden. Hier müssen gegebenenfalls Prioritäten in der Analyse gesetzt werden. Wer eine ausführliche Schritt-für-Schritt-Anleitung zur cisternalen Liquorpunktion sucht, dem kann ich Quelle 1 und 2 (in letzterer wird auch die lumbale Punktion beschrieben) empfehlen.
Die Liquoranalyse
Wer mit dem Gedanken spielt, Liquorentnahmen in seiner Praxis oder Klinik durchführen zu lassen, sollte zuvor die Möglichkeiten der Liquoranalyse überdenken, denn eine zeitnahe Analyse innerhalb von 30-60 (-90) Minuten muss gewährleistet sein. Da Liquor als Ultrafiltrat aus Blut sehr protein- und nährstoffarm ist, ist das Milieu sehr zellunfreundlich, was dazu führt, dass die enthaltenen Zellen nicht lange stabil sind. Daher muss eine schnelle Basisanalyse vor Ort gewährleistet sein. Es gibt noch ein paar Tricks zur Konservierung, um auch ein paar Sachen später als 60 Minuten nach Entnahme zu untersuchen oder zur Untersuchung in ein Fremdlabor zu senden, dazu dann an entsprechender Stelle mehr.
1. Makroskopische Beurteilung des Liquors
Begonnen wird nämlich mit der makroskopische Beurteilung des entnommenen Liquors. Liquor wird nach Farbe und Trübung/Transparenz beurteilt. Physiologisch stellt er sich farblos und wasserklar/ transparent dar. Abweichungen der Farbe sind zum einen eine Gelbfärbung, eine sogenannte „Xanthochromie“, die durch die Abbauprodukte älterer Blutungen (2-6 Tage alt) zustande kommt. Zum anderen kann eine rötliche Verfärbung durch akute Blutungen auftreten. Dabei muss zwischen einer echten Blutung ins ZNS und einer Blutkontamination unterschieden werden. Während die echte Blutung eine homogene rötliche Verfärbung verursacht, ist letztere eher als rote Schlieren sichtbar, die auch bereits bei der Entnahme des Liquors im Konus der Spinalkanüle, sowie im Untersuchungsröhrchen im ansonsten eher unveränderten Liquor absedimentieren.
Nach der Farbe wird die Trübung beurteilt. Physiologisch ist der Liquor klar bzw. durchsichtig. Die unphysiologische Trübung wird als einfach bis dreifach positiv bewertet. Dafür wird der Liquor im Röhrchen vor einen dunklen Hintergrund gehalten. Die Trübung ist abhängig vom Zellgehalt (nicht Protein!). Ein Zellgehalt bis 5 Zellen/µl ist physiologisch. Eine Abweichung, die vom menschlichen Auge erkennbar ist, ist erst ab 500 Zellen/µl möglich. Das heißt:


Abbildung 2: A: Beispiel für einen makroskopisch physiologischen Liquor. B: Beispiel für einen pathologischen Liquor mit ausgeprägter Xanthochromie und milder Trübung.
2. Proteingehalt und Pandy-Reaktion
Liquor ist als Ultrafiltrat des Blutes nicht nur zellarm, sondern auch proteinarm. Der Grenzwert für den Proteingehalt des entnommenen Liquors ist abhängig vom Entnahmeort und liegt cisternal bei unter 0,25 g/l und lumbal bei unter 0,4 (- 0,45 g/l). Die Bestimmung des Proteingehaltes wird in der Regel in einem externen Labor durchgeführt. Dafür kann der Liquor unkonserviert verschickt werden und dies ist auch eine der Analysen, die noch nach 60 Minuten nach Entnahme problemlos möglich ist.
Als "albuminozytologische Dissoziation" bezeichnet man das Phänomen eines erhöhten Gesamtproteingehalts bei normaler Zellzahl (unter 5 Zellen/µl). Dies kann bei Tumorerkrankungen des ZNS, Infarkten, neurodegenerativen, neurokompressiven und traumatischen Prozessen am ZNS, sowie beî Fieber vorkommen. Damit ist es zwar eher eine unspezifische Veränderung, die uns aber vor allem bei grenzwertig normaler Bildgebung des ZNS mittteilt, das sich hier definitiv ein relevanter Vorgang abspielt.
Die Pandy-Reaktion ist eine einfache Möglichkeit um semiquantitativ Immunglobuline nachzuweisen. Hierfür werden einige wenige Tropfen des Liquors in ein schwarzes Gefäß, das mit wässriger Phenollösung gefüllt ist, gegeben. Bei erhöhtem Immunglobulingehalt, wie im Rahmen von Entzündungsprozessen, fällt das Protein der Immunglobuline aus und wird als Trübung sichtbar.
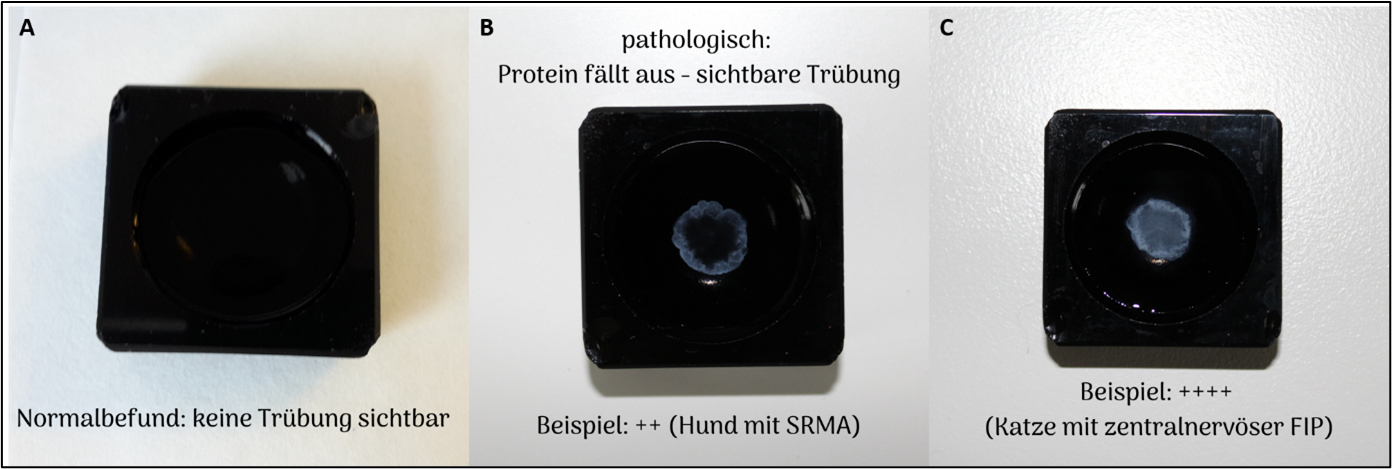
Abbildung 3: A: Normalbefund der Pandy-Reaktion, B: 2-fach positive Pandy-Reaktion bei einem Hund mit SRMA, C: 4-fach positive Pandy-Reaktion bei einer Katze mit einer zentralnervösen FIP-Infektion
3. Zellzahl
Nun kommen wir zu dem Teil, der unbedingt zeitnah analysiert werden sollte. Da Liquor eine zellarme Flüssigkeit mit zellunfreundlichem Milieu ist, sind die Zellen im Liquor häufig nicht sehr lange stabil, sondern beginnen rasch zu zerfallen. Daher sollte die Zellzählung zeitnah nach Entnahme erfolgen (etwa 30-60 Minuten nach Entnahme).
Aufgrund der geringen physiologischen Zellzahl von maximal 5 Zellen/µl ist natürlich eine Analyse mit einem Zellzählgerät wie dem ProCyte unsinnig, daher wird hier noch Handarbeit verlangt. Für die Zellzählung kann eine Fuchs-Rosenthal oder Neubauer-Zählkammer genutzt werden. Es werden 90 µl Liquor mit 10 µl Methylenblau zur Anfärbung der Zellen in einem Eppendorfgefäß vermischt, 3 Minuten gewartet, damit sich die kernhaltigen Zellen anfärben und dann die Zählkammer befüllt. Anschließend nochmals 3 Minuten gewartet, damit sich die Zellen absetzen und dann können 16 Quadranten des Gitternetztes unter dem Mikroskop ausgezählt werden (L-Prinzip für den Randbereich beachten).
Zuerst werden alle kernhaltigen Zellen (vermutlich Leukozyten) ausgezählt. Die ausgezählte Zellzahl muss dann noch durch 3 geteilt werden, da das Füllvolumen der Zählkammer 3 µl beträgt und wir die Zellzahl pro µl benötigen. Anschließend werden alle Erythrozyten ausgezählt in den 16 Quadranten (sofern denn überhaupt welche vorhanden sind). Dabei gilt: pro 500 Erythrozyten wird eine kernhaltige Zelle von der Gesamtzellzahl abgezogen, da davon ausgegangen wird, dass bei einer Blutkontamination pro 500 Erythrozyten 1 Leukozyt mit "eingeschleppt" wird. Nach der Erythrozytenkorrektur erhält man die korrigierte Gesamtzellzahl, welche maximal 5 Zellen/µl betragen sollte. Alles darüber wird als pathologisch gewertet.
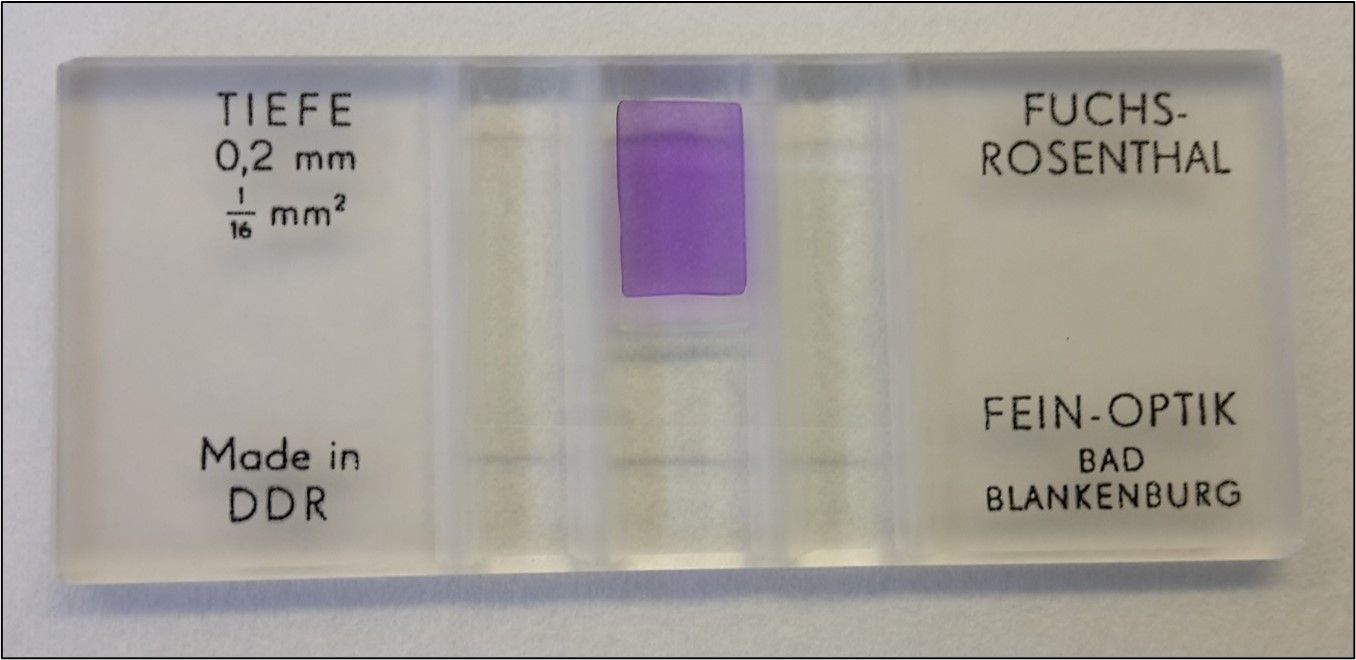
Abbildung 4: Befüllte Fuchs-Rosenthal Zählkammer zur Auszählung der Zellen im Liquor
4. Zelldifferenzierung
Aufgrund der geringen Zellzahl im Liquor macht zum Zwecke einer Differenzierung natürlich ein Ausstrich keinen Sinn. Da könnte man die wenigen Zellen erst recht nicht wieder finden. Daher versuchen wir die Zelldichte an einem bestimmten Fleck zu erhöhen und so kommt die Sedimentierkammer ins Spiel. Es muss nicht immer eine professionelle Sayksche Sedimentierkammer sein, es gibt auch günstigere Varianten Marke "Eigenbau". Aber das Prinzip ist bei allen gleich:
Auf den Objektträger wird ein Löschpapier mit einem Loch in der Mitte aufgebracht. Über diesem Loch befindet sich der Sedimentierzylinder, der durch eine Vorrichtung auf den Objektträger gespannt oder gepresst wird. In den Zylinder werden nun 500 µl Liquor mit einer Pipette am Boden abgesetzt. Das Löschpapier zieht langsam die Flüssigkeit heraus und die Zellen sedimentieren im "Loch" ab. Dabei muss darauf geachtet werden, dass der Liquor nicht zu schnell fließt, ansonsten zieht es die Zellen hinterher. Über die Stellschrauben kann die Flussgeschwindigkeit beeinflusst werden. Wenn der gesamte Liquor durchgelaufen ist, markiert man sich mit einem Stift auf der Unterseite des Objektträgers den Sedimentierbereich, ansonsten kann man unter dem Mikroskop lange suchen. Dann noch trocknen und anfärben und schon kann es losgehen.

Abbildung 5: Sayksche Sedimentierkammer zur Anfertigung eines Präparats zur Liquordifferenzierung
Physiologischer Weise findet sich ein mononukleäres Zellbild aus wenigen Monozyten und Lymphozyten. Zu den pathologischen Zellbildern gehören eine lymphozytäre Pleozytose, eine neutrophile Pleozytose, ein eosinophiles Zellbild oder eine gemischtzellige Pleozytose. Weiterhin können hin und wieder Ependymzellen oder auch Tumorzellen (Lymphom, Meningiom, Plexustumor) auftreten.
Eine lymphozytäre Pleozytose kann auf ein zentrales Lymphom hindeuten, besonders wenn das Zellbild aus sich ziemlich ähnlich sehenden Lymphoblasten besteht. Eine weitere Ursache kann eine virale Infektion sein. Eine neutrophile Pleozytose sehen wir klassischer Weise bei jungen Hunden mit SRMA (Steroid-responsive Meningitis und Arteriitis), bei Katzen mit einer zentralnervösen Form der FIP (Feline infektiöse Peritonitis), bei einer bakteriellen Ätiologie (zum Beispiel durchgebrochene Otitis media/interna oder Hirnabszess) und manchmal auch bei neoplastischen Prozessen. Ein eosinophiles Zellbild spricht für eine autoimmune Ursache, Toxoplasmose, Neosporose oder eine parasitäre Genese (z.B. Larva migrans des Angiostrongylus vasorum). Eine gemischte Pleozytose kann bei fast allen Ursachen auftreten (viral, protozoal, parasitär, fungal, neoplastisch) und ist auch häufig bei der autoimmun-bedingten Meningoenzephalitis unbekannter Genese anzutreffen.
Sollte man sich die Differenzierung nicht zutrauen, kann man eine externe Differenzierung im Fremdlabor machen lassen. Hier sollten die Zellen zuvor konserviert werden, da diese sonst zerfallen. Man kann den entnommen Liquor halbieren. 1. Hälfte für Proteingehalt und Zellzahl verwenden und zur 2. Hälfte 1 Tropfen Formalin geben und dann außer Haus differenzieren lassen. Allerdings verlieren die Zellen etwas an Form und könnten schwerer zu unterscheiden sein.
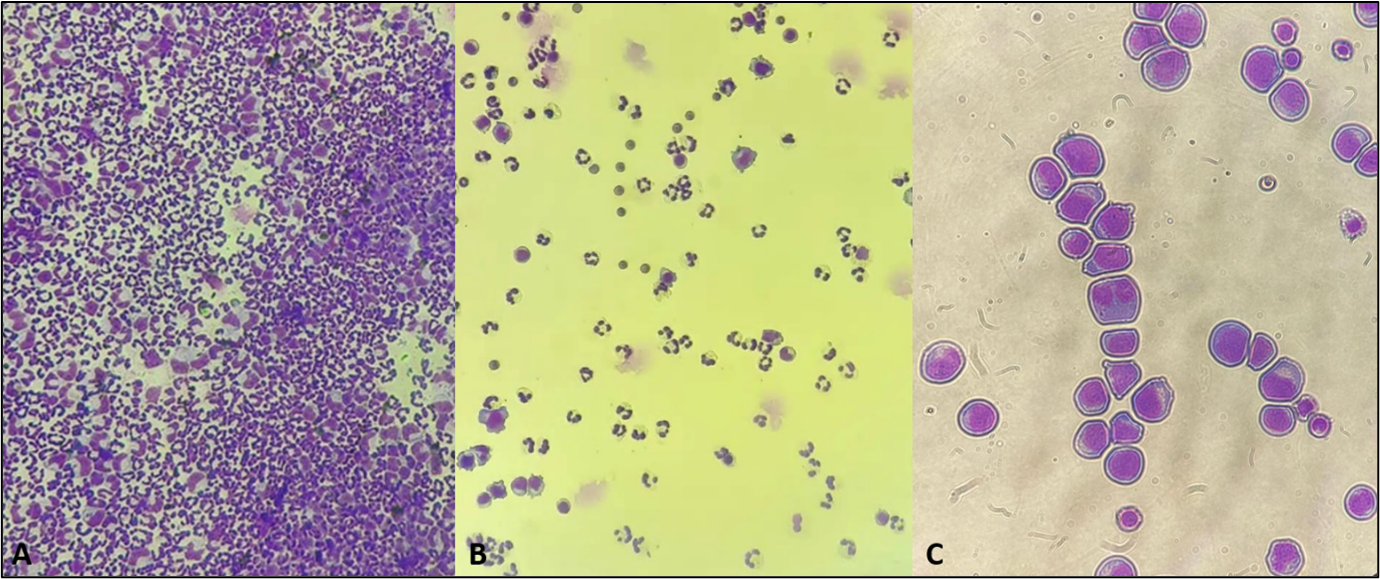
Abbildung 6: Pathologische Liquorzytologien A: Hochgradige neutrophile Pleozytose aufgrund einer bakteriellen Meningoenzephalitis nach traumatischer Fraktur der Lamina cribrosa bei einer Katze, B: Moderate neutrophile Pleozytose aufgrund eines beginnenden Durchbruchs einer bakteriellen Otitis media et interna bei einer Französischen Bulldogge; C: Liquorzytologie einer Katze mit spinalem Lymphom
5. Spezielle Untersuchungen
Zum Ende möchte ich noch einen kleinen Ausblick auf einige Spezialuntersuchungen geben, die an die basale Liquoruntersuchung bei entsprechenden Verdacht oder entsprechenden pathologischen Befunden angeschlossen werden können.
Beim jungen Hund mit Halswirbelsäulendolenz und einer neutrophilen Pleozytose im Liquor kann zur weiteren Abklärung einer SRMA als Ursache das Immunglobulin A und das c-reaktive Protein aus dem Liquor eingeleitet werden.
Beim Verdacht einer bakteriell bedingten neutrophilen Pleozytose kann eine bakteriologische Untersuchung mit Anzucht der Erreger aus dem Liquor versucht werden. Leider ist dies oft sehr schwierig und eher wenig erfolgsversprechend, weswegen auch die Möglichkeit besteht die 16s-rRNA Gensequenz aus dem Liquor nachzuweisen. Gegebenenfalls kann auch der Glukosewert im Liquor im Vergleich zum Blut hilfreich sein, der dann entsprechend erniedrigt wäre.
Bei einer lymphozytären Pleozytose, bei der alle Lymphozyten auch sehr ähnlich aussehen, kann eine PARR (PCR for Antigen Receptor Rearrangements) weiteren Aufschluss bringen. Leider ist für eine aussagekräftige Analyse eine Mindestzellzahl von etwa 50 000 Zellen nötig, das heißt bei einer Zellzahl von 100 Zellen/µl müssen mindestens 500 µl also 0,5 ml versendet werden, um wirklich ein aussagekräftiges Ergebnis zu bekommen. Viele Labore können aber auch die Zellen vom Objektträger, der für die Differenzierung genutzt wurde, wieder lösen und nutzen. Die PARR-Analyse kann hilfreich sein, wenn der Verdacht auf ein zentrales Lymphom aufgrund der Differenzierung besteht. In diesem Falle wäre eine monoklonale Lymphozytenpopulation zu erwarten.
Oft stellt sich die Frage: Handelt es sich bei der entzündlichen Pleozytose, die ich sehe, um eine infektiöse oder auto-immunbedingte Entzündung? Hier sollte beachtet werden, dass der Großteil der entzündlichen Veränderungen des ZNS bei Hund und Katze in unseren Breiten immunbedingter Natur sind. Trotzdem sollten gewisse Infektionserreger immer mit abgeklärt werden. Diese wechseln entsprechend dem zytologischen Bild im Liquor, dem Läsionstyp in der Bildgebung, den Symptomen, der Rasse, des Alters, des Impfstatus und der Auslandsanamnese des Tieres. Alle Möglichkeiten kann man meist nicht abklären, da zu wenig Liquormaterial dafür da ist und auch der Geldbeutel der Besitzer sicherlich irgendwann streikt. So sollte man sich auf die wesentlichen Erreger für den spezifischen Verdachtsfall beschränken, die wichtigsten Untersuchungen wenn möglich auch aus dem Liquor einleiten und anschließend mit Antikörpernachweisen aus dem Blut arbeiten.
Ein kleiner Überblick über potentiell relevante Infektionserreger (nicht für alle ist der Nachweis aus dem Liquor etabliert):
- Toxoplasma gondii
- Neospora canium
- Staupe
- FelV/FIV (Katze)
- FIP (Katze)
- FSME
- West-Nile-Virus
- Borna-Virus
- Rustrela-Virus (Staggering Disease Katze)
- Herpes-Virus
- Tollwut
- Aujeszkysche Krankheit
- Enzephalitozoon cuniculi
- Angylostrongylus vasorum, Dirofilaria immitis, Toxocara canis, Ancylostoma canium
- Echinococcus
- Cryptococcus, Aspergillus
- Prototheken
- Ehrlichien, Anaplasmen
- Borrelien
- Listerien
- Leishmanien
- Babesien
Bei immunmediierten Entzündungen können zum Teil auch Auto-Antikörper und oligoklonale Banden nachgewiesen werden, was derzeit ein großer Interessenschwerpunkt der veterinärmedizinischen neuroimmunologischen Forschung ist.
Zum Weiterlesen:
[1] T. Flegel, S. Hanemann. Subokzipitale Punktion des Subarachnoidalraums beim Hund. kleintier konkret 2017; 20(03): 40-41. DOI: 10.1055/s-0043-107906
[2] Cook JR Jr, DeNicola DB. Cerebrospinal fluid. Vet Clin North Am Small Anim Pract. 1988 May;18(3):475-99. doi: 10.1016/s0195-5616(88)50051-7. PMID: 3289242
[3] W. Baumgartner. Klinische Propädeutik der Haus- und Heimtiere. Kapitel 12.4 Untersuchung des Liquor cerebrospinalis. Georg Thieme Verlag KG, Stuttgart. S. 481-483. DOI: 10.1055/b-0035-124331
[4] Leschnik, M. W., Benetka, V., Url, A., Pakozdy, A., Thaller, D., Bilek, A., ... & Mostl, K. (2008). Virale Enzephalitiden beim Hund in Osterreich: diagnostische und epidemiologische Aspekte. Wiener Tieraerztliche Monatsschrift, 95(7), 190.
[5] Tipold A, Schatzberg SJ. An update on steroid responsive meningitis-arteritis. J Small Anim Pract. 2010 Mar;51(3):150-4. doi: 10.1111/j.1748-5827.2009.00848.x. Epub 2010 Jan 11. PMID: 20070497.
[6] Prümmer JK, Stein VM, Marti E, Lutterotti A, Jelcic I, Schüpbach-Regula G, Buch T, Maiolini A. Assessment of oligoclonal bands in cerebrospinal fluid and serum of dogs with meningoencephalitis of unknown origin. PLoS One. 2023 Jan 25;18(1):e0280864. doi: 10.1371/journal.pone.0280864.
[7] Lane LV, Meinkoth JH, Brunker J, Smith SK 2nd, Snider TA, Thomas J, Bradway D, Love BC. Disseminated protothecosis diagnosed by evaluation of CSF in a dog. Vet Clin Pathol. 2012 Mar;41(1):147-52. doi: 10.1111/j.1939-165X.2011.00395.x.
[8] Lavely J, Lipsitz D. Fungal infections of the central nervous system in the dog and cat. Clin Tech Small Anim Pract. 2005 Nov;20(4):212-9. doi: 10.1053/j.ctsap.2005.07.001.
[9] Windsor RC, Sturges BK, Vernau KM, Vernau W. Cerebrospinal fluid eosinophilia in dogs. J Vet Intern Med. 2009 Mar-Apr;23(2):275-81. doi: 10.1111/j.1939-1676.2009.0276.x.
[10] Schatzberg SJ, Haley NJ, Barr SC, deLahunta A, Olby N, Munana K, Sharp NJ. Use of a multiplex polymerase chain reaction assay in the antemortem diagnosis of toxoplasmosis and neosporosis in the central nervous system of cats and dogs. Am J Vet Res. 2003 Dec;64(12):1507-13. doi: 10.2460/ajvr.2003.64.1507.